O Número de Oxidação ou NOX é a carga elétrica que um átomo adquire ao participar de uma ligação.
Poderemos ter carga real ou carga aparente.
Quando for um composto iônico, temos carga elétrica, resultante da transferência de elétrtons (carga real).
Já no caso de um composto covalente ou molecular, representa-se uma carga aparente. Esta expressará o deslocamento de um par eletrônico na direção do elemento de maior eletronegatividade.
Pode-se também falar de um carga parcial que o elemento adquire, quando o par eletrônico compartilhado se aproxima do elemento mais eletronegativo e se afasta do elemento menos eletropositivo.
RECORDANDO:
A eletronegatividade é a tendência que um elemento tem de atrair elétrons, e o NOX está intimamente ligado a esse conceito.
Por exemplo, a ligação que forma o sal de cozinha (cloreto de sódio - NaCl) é iônica, ou seja, há transferência de elétrons de um átomo para outro. No caso, o sódio (Na) perde um elétron para o cloro, assim se formam dois íons, Na+ e Cl-. Visto que essa ligação é iônica, o NOX desses elementos é a sua própria carga, isto é, o NOX do Na é +1 e o NOX do Cl é -1.
Agora considere o caso de uma ligação covalente. Uma molécula de água (H2O) é formada pelo compartilhamento de elétrons entre cada átomo de hidrogênio e o oxigênio, conforme mostrado abaixo. Se essas ligações fossem rompidas, o oxigênio, que é o elemento mais eletronegativo, ficaria com mais dois elétrons, obtendo NOX igual a -2 (porque os elétrons são negativos). Visto que cada hidrogênio perdeu um elétron, o NOX de cada um deles seria +1.

NOX de elementos em uma molécula de água
Assim, se determinarmos o NOX de cada elemento nas reações e observarmos que houve alguma alteração neles, ou seja, que aumentaram ou diminuíram, isso mostrará que a reação é de oxirredução e saberemos quem reduziu e quem oxidou. Se o NOX aumentar, o elemento sofreu oxidação, mas se diminuir, significa que o elemento sofreu redução.
Existem alguns NOX que são fixos, mas o da maioria dos elementos muda de acordo com o tipo de ligação realizado na molécula ou fórmula unitária. Veja alguns exemplos que praticamente permanecem inalterados:
- H → o hidrogênio, em quase todos os casos, encontra-se com o NOX igual a +1. Ele só terá o NOX -1 se estiver ligado a metais, que são menos eletronegativos que ele;
- O → o oxigênio possui NOX -2 na maioria das substâncias, mas existem algumas exceções: seu NOX será -1 em peróxidos, -1/2 em superóxidos e pode ser +2 ou +1 em fluoretos;
- Metais alcalinos (elementos da família 1: Li, Na, K, Rb, Cs) → sempre que estiverem em substâncias compostas, eles terão o NOX +1;Metais alcalinoterrosos (elementos da família 2: Be, Mg, Ca, Sr, Ba) → sempre que estiverem em substâncias compostas, eles terão o NOX +2;
- Halogênios (elementos da família 17 (ou 7 A): F, Cl, Br, I) → sempre que o halogênio for o elemento mais eletronegativo, que é na maioria dos casos, ele terá o NOX -1.
Agora veja algumas regras para a determinação do NOX:
- Substâncias simples: o NOXsempre é zero;
- Íons monoatômicos (formados por um único tipo de átomo): o NOX é igual à própria carga do íon;
- Íons compostos: A soma dos NOX dos elementos que compõem o íon é sempre igual à sua carga;
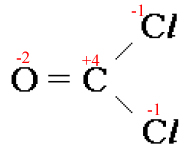
- Substâncias compostas: A soma dos NOX dos elementos que compõem a substância é sempre zero.
Agora, vamos usar essas regras para determinar o NOX dos elementos nos exemplos abaixo:

Importante:

Importante:
- Na1+: NOX = +1 (íon monoatômico)
- N2: NOX = 0 (substância simples)
- O2: NOX = 0 (substância simples)
- Fe: NOX = 0 (substância simples)
- O2-: NOX = -2 (íon monoatômico)
- F1-: NOX = -1 (íon monoatômico)
- HF: NOX H = +1; NOX F = -1 (veja que a soma de seus NOXé zero (+1 -1 = 0)
- NH41+: NOX H = +1
Exemplos:

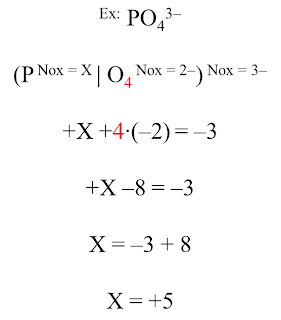
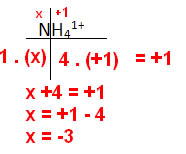





ELETROQUÍMICA
Pilha ou Bateria:
É todo dispositivo no qual a ocorrência de reações químicas produzem uma corrente elétrica.
Eletrodo:
É um conjunto contendo uma barra metálica, mergulhada numa solução aquosa contendo íons do mesmo metal que constitui a barra metálica.
Potencial de Eletrodo:
Mede em VOLTS a tendência de um metal sofrer oxidação ou redução quando mergulhado numa solução contendo íons deste mesmo metal.
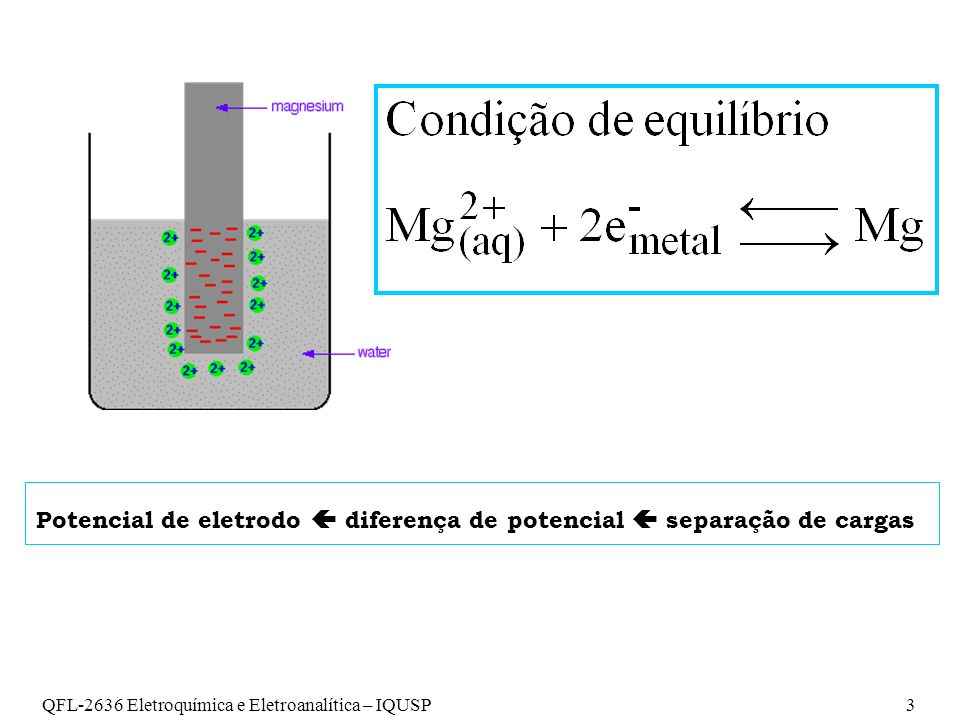
Potencial de Eletrodo:
Mede em VOLTS a tendência de um metal sofrer oxidação ou redução quando mergulhado numa solução contendo íons deste mesmo metal.

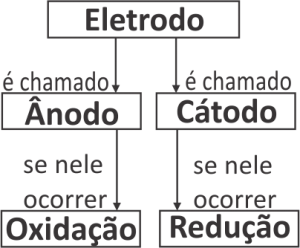

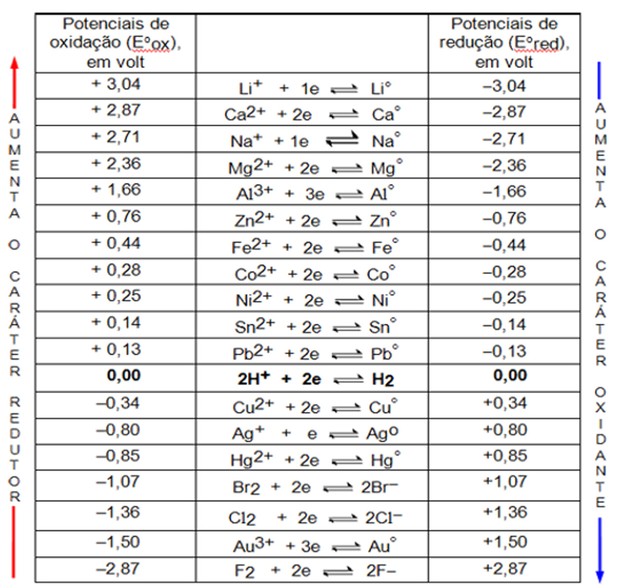
TABELA DE POTENCIAIS (VOLT)
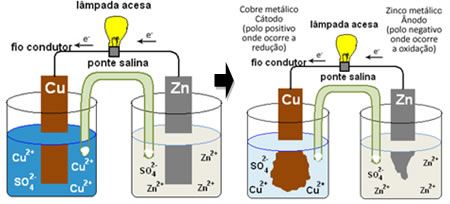
PILHA de DANIELL

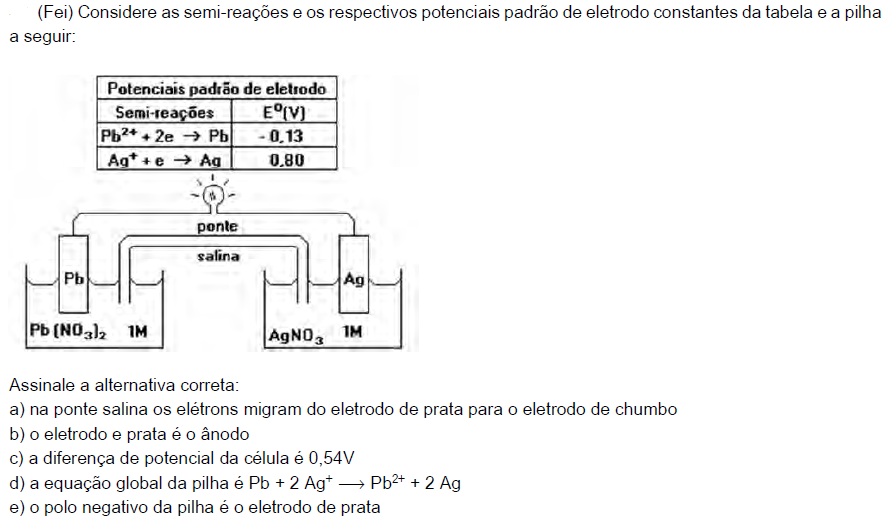
EXERCÍCIOS


c) Nenhuma das alternativas anteriores.
d) As letras A e B anteriores estão corretas.
06)


Nenhum comentário:
Postar um comentário